Thermodynamische Modellierung und experimentelle Untersuchung von Phasenumwandlungen
Berechnung des Kristallisationsdrucks
Ausgehend vom chemischen Potential eines unter anisotroper Spannung stehenden Festkörpers lässt sich folgende Gleichung für den Kristallisationsdruck eines Salzes ableiten:
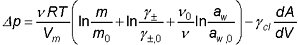
Es ist Δp der Kristallisationsdruck, ν die Anzahl der Ionen, die bei der Lösung des Salzes freigesetzt werden, R die Gaskonstante, T die Temperatur, und Vm das Molvolumen des Salzes. Weiterhin ist m die Molalität der Salzlösung im Porenraum, m0 die Sättigungsmolalität des nicht unter Druck stehenden Kristalls, γ± und γ±,0 sind die Aktivitätskoeffizienten bei den Konzentrationen m bzw. m0. Bei Hydratsalzen ist weiterhin der letzte Term im Klammerausdruck zu beachten. Hier sind aw bzw. aw,0 die Wasseraktivitäten bei den Konzentrationen m bzw. m0. Weiterhin ist ν0 die Anzahl der Hydratwassermoleküle, die bei der Dissoziation des Salzes freigesetzt werden.
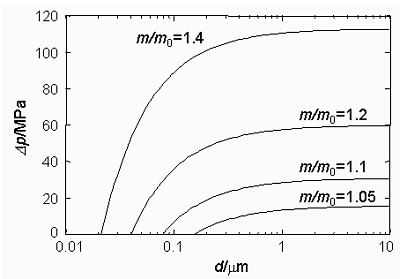 |
Der letzte Term der Gleichung beschreibt die Abhängigkeit des Kristallisationsdruckes von der Kristallgröße. Es sind A und V die Oberfläche und das Volumen des Kristalls, γcl ist die freie Oberflächenenergie der Grenzfläche Kristall/Lösung. Für einen würfelförmigen NaCl-Kristall ergeben sich für verschiedene Übersättigungen die in nebenstehender Abbildung dargestellten Abhängigkeiten des Kristallisationsdrucks von der Kantenlänge d des Würfels.
|
 Ansprechpartner:
Dr. rer. nat. Michael Steiger,
Ansprechpartner:
Dr. rer. nat. Michael Steiger,
Institut für Anorganische und Angewandte Chemie, Universität Hamburg
|